胃癌是亚洲高发的恶性肿瘤,我国每年新发病例占世界新发病例的40%以上。不同于日韩地区较高的早期胃癌诊断率,我国初诊进展期病例占总体的70%以上,单纯手术难以取得理想的疗效。近年来随着放疗技术的进步,治疗毒性的减轻,放疗在进展期胃癌的应用价值引起了越来越多的注意。
进展期胃癌术后放化疗——更多疑问、更多挑战
美国
进展期胃癌即使在R0切除后仍有一定几率复发,术后加入同步放化疗是否能够改善生存?最初美国的INT-0116研究给出了肯定的答案。
2001年发表的INT-0116研究入组556例ⅠB~Ⅳ期(M0)胃癌术后患者,其中单纯手术组275例,术后同步放化疗+化疗组281例,结果显示,术后接受同步放化疗和单纯手术组患者的3年无复发生存(RFS)率和3年总生存(OS)率有显著差异(48%对31%,P<0.001;52%对41%,P=0.005)。2012年INT-0116研究超过10年的随访结果显示,OS的危险比(HR)为1.32(P=0.0046),RFS的HR为1.51(P<0.001),提示胃癌根治术后患者接受同步放化疗可有长期临床获益。自INT-0116研究结果正式发表后,辅助化疗+同步放化疗成为北美胃癌根治术后患者的标准治疗。
亚洲
在胃癌D2根治术应用更普遍的亚洲,研究者认为INT-0116研究的总体疗效并不理想,超过90%的患者未行D2根治术,54%的患者未达到D1清扫,放疗的加入可能仅仅是弥补了手术的不足。另一方面,该研究同步放化疗组治疗毒性高,超过1/3患者无法按计划完成治疗,因此尽管INT-0116研究结果首次确认了胃癌术后同步放化疗的疗效,但是北美以外地区对该治疗模式的推广存在顾虑。
韩国ARTIST研究是另一项重要的评估同步放化疗疗效的Ⅲ期临床研究。该研究方法为患者接受胃癌D2切除术后随机分为XP组和同步放化疗组,XP组接受6周期XP方案(顺铂+卡培他滨)化疗;同步放化组接受2周期XP方案化疗后,完成同步放化疗(45 Gy,卡培他滨)和随后的2周期XP方案化疗。研究入组458例患者,其中XP组228例,同步放化疗组230例,2012年报告的主要研究终点3年无疾病生存(DFS)率为74.2%对78.2%,从整体看联合放疗不能改善DFS率;2015年报告的长期随访结果同样如此。但有专家认为,阴性结果可能与入组患者分期早相关,研究中虽然对手术进行了严格的把关,但全组仍有60%为Ⅰ~Ⅱ期患者,淋巴结(﹢)亚组的3年DFS率为72.3%对77.5%(P=0.0365),局部复发率从13%降低至7%。在Lauren分型为肠型胃癌的患者中,同步放化疗组DFS也有获益。
韩国2012年报告的另一项D2根治术后同步放化疗的Ⅲ期研究也有相似结果。该研究在D2根治术后Ⅲ~Ⅳ(M0)期胃癌患者中评估辅助化疗基础上同步放化疗的疗效。亚组分析显示,同步放化疗组比化疗组提高了Ⅲ期患者的5年无局部区域复发生存率(93.2%对66.8%,P=0.014)和5年DFS率(73.5%对54.6%,P=0.056)。因此对于特定的进展期胃癌术后患者,术后联合放疗可能起到改善生存、降低复发的作用。目前韩国开展了针对病理学淋巴结(﹢)胃癌患者的术后放化疗随机对照试验(ARTIST-Ⅱ试验)。中国国家癌症中心开展的胃癌术后同步放化疗前瞻性Ⅱ期临床研究显示3年DFS率为66.2%,3级以上毒性发生率达22.5%。
欧洲
欧洲2011年启动的CRITICS国际多中心研究试图将MAGIC研究的术前化疗模式和INT 0116研究的术后同步放化疗的模式结合起来,共入组788例可切除胃癌患者,术前完成新辅助化疗3周期后行胃癌根治术和淋巴结清扫(D1+),术后随机分为化疗组和同步放化疗组。长期随访后两组间5年OS率及5年无进展生存(PFS)率均未见显著差异。
有学者认为放射治疗的作用在该研究中并未得到充分发挥,放疗靶区设置的争议和入组患者不足一半的整体治疗完成率,有可能削弱术后放化疗的生存获益。
总体来说,对于已行D2手术的进展期胃癌,术后加入放疗未能获得生存优势,但淋巴结阳性和Lauren分型为肠型的亚组患者仍有生存获益趋势。同时,对于各种原因导致手术未能达到D2标准的进展期胃癌术后患者,术后同步放化疗仍可作为推荐治疗。
进展期胃癌术前新辅助同步放化疗——渐入佳境
进展期胃癌采用术前新辅助治疗的理论优势显而易见:① 可尽早控制局部和(或)远处的微转移病灶;② 降低局部晚期肿瘤特别是最初无法手术患者的肿瘤分期,提高R0切除率;③ 抑制肿瘤细胞活性,减少术中发生种植播散的可能;④ 患者未经手术处理因而对治疗耐受性更好;⑤ 肿瘤对术前治疗的病理反应为后续治疗提供参考。术前同步放化疗同时包含了局部和全身治疗,理论上可提供更好的疗效,但目前还有待相关的研究结果进一步明确。
美国MD安德森癌症中心开展过前瞻性Ⅱ期研究,结果显示接受术前同步放化疗患者的病理完全缓解(pCR)率为20%~30%,R0手术切除率为70%~80%。中国国家癌症中心开展的前瞻性研究中术前同步放化疗组pCR率为17.4%,R0切除率为81.8%。
2012年发表的CROSS研究是针对食管和胃食管交界部癌患者的Ⅲ期研究,结果显示,术前同步放化疗[41.4 Gy,PC方案(紫杉醇+顺铂)化疗]可显著改善患者生存,单纯手术组和术前同步放化疗组的3年OS率为48%对59%(P=0.008);同步放化疗组患者pCR率为29%,鳞癌患者的pCR率高于腺癌患者(49%对23%);术前同步放化疗组的R0切除率显著高于单纯手术组(92.3%对67.0%,P<0.002);术前同步放化疗组的耐受性良好,≥90%的患者完成了所有5个周期的治疗,同步放化疗组的3级血液学和非血液学不良反应发生率分别为7%和13%,4级、5级不良反应各1例。CROSS研究的结果对于胃癌术前同步放化疗研究有重要的借鉴意义。
澳大利亚TROG研究组联合多个国际研究组织于2011年启动了TOPGEAR国际多中心研究评估术前同步放化疗的模式,研究同样将MAGIC研究中术前+术后化疗的模式设定为对照组。研究针对可切除胃癌患者,先随机分为术前化疗组接受3周期的ECF方案[表柔比星+顺铂+氟尿嘧啶(5FU)]化疗或术前同步放化疗组接受同步放化疗(45 Gy,5FU方案)+2周期ECF方案化疗,然后行胃癌D1根治术并继续完成3周期ECF方案化疗。TOPGEAR研究包括Ⅱ期和Ⅲ期研究两部分,预期分别入组患者120例和632例,旨在评估该方案与MAGIC试验围手术期化疗方案的区别,探索是否可以提高pCR率进而改善总体生存。TOPGEAR研究的初步结果显示,术前放化疗可以被更多患者耐受,并未增加明显的治疗毒性和手术并发症的发生率。这无疑给胃癌术前放化疗的应用增加很多期待。
我国复旦大学附属肿瘤医院于2012-2014年进行了一项局部进展期胃癌术前放化疗的Ⅱ期临床研究(NCT02024217)。该研究共入组40例分期为cT4aN﹢M0或cT4bNxM0的胃或胃食管结合部腺癌患者,其中36例完成术前治疗,R0切除率为67%(24/36),pCR率为13.9%(5/36)。术前治疗的毒性反应在可接受范围内,且无放化疗相关的死亡病例。在Ⅱ期研究的基础上,复旦大学附属肿瘤医院开展了胃癌术前放化疗对比术前化疗的Ⅲ期研究(PREACT研究,NCT03013010),中山大学肿瘤防治中心开展的局部晚期胃癌术前放化疗对比术前化疗的研究也在如火如荼地进行,两项研究设计与前者的Ⅱ期研究类似,期待这两项Ⅲ期临床研究结果能够指导临床应用,给患者带来新的获益。
姑息性放化疗——可能生存获益
对于局部肿瘤不可切除且一般情况较差的患者,首选单纯化疗±放疗。这部分患者主要治疗目的是缓解临床症状,提高生存质量。与最佳支持治疗相比,化疗可延长晚期或转移性胃癌患者生存;放疗可显著缓解晚期胃癌患者的一些临床症状,如出血、疼痛、吞咽困难等,起到提高生活质量的作用。肿瘤分期晚、高龄、心肺功能差或合并多发基础疾病而不考虑手术治疗者,可考虑姑息性放疗。
对于围手术期未接受过放疗的胃癌局部复发患者,同步放化疗可能得到生存获益。回顾性研究显示,对于根治术后局部吻合口复发和(或)区域淋巴结转移的患者,同步放化疗的反应率高达61.9%,中位生存期为35个月。相对于单纯化疗而言,同步放疗联合化疗的缓解率更高(87.8%对63.0%,P=0.01),疼痛、出血及梗阻的症状控制更为明显(85.0%对55.9%,P=0.006),同时中位生存期也更长(13.4个月对5.4个月,P=0.06)。中国国家癌症中心应用尼妥珠单抗联合卡培他滨同步放化疗治疗不可手术、术后残存或复发胃癌患者的前瞻性研究显示,治疗后1个月内客观缓解率达43%[完全缓解(CR)率为4%、部分缓解(PR)率为39%],稳定率为50%,3级急性毒性发生率为17%,疗效和安全性均可。
放疗靶区和放疗技术要求
INT-0116研究的照射部位包括残胃、瘤床、吻合口和淋巴结引流区。2008年韩国学者发表研究评估在保证疗效的同时缩小放射野范围(不包括残胃)以减少不良反应的策略,回顾性分析291例接受D2根治术后辅助放化疗患者,分为照射靶体积包括残胃(根据INT-0116研究)的患者(A组,88例)和靶体积不包括残胃的患者(B组,208例),中位随访67个月。结果显示,A组与B组的局部和区域复发率分别为10.8%对5.3%(P值不显著)、9.6%对6.3%(P值不显著),总生存(OS)和无疾病生存(DFS)在两组间无差异,3~4级不良反应中 呕吐和腹泻的发生率在A组均高于B组。该研究提示,接受D2切除的胃癌患者照射野不包括残胃对生存无影响且并发症的发生率低。ARTIST研究据此采用的放疗靶区包括瘤床、吻合部位、十二指肠残端和区域淋巴结,残胃不包括在照射区内(T4病变除外)。
应用放疗新技术三维适形放疗(3DCRT)和调强放疗(IMRT)可优化靶区内的剂量分布,同时降低靶区周围重要组织器官的受照射剂量。近期开展的临床研究如CRITICS研究已经明确放弃常规放疗技术而只采用3DCRT和IMRT技术以提高患者对放疗的耐受性,减少不良反应。CRITICS研究中临床靶区(CTV)包括瘤床、吻合部、引流区淋巴结。
目前中国国家癌症中心推荐的胃癌术后靶区定义如下:肿瘤区(GTV)为可视或定位明确的肿瘤残存病灶,CTV包括GTV、吻合口、残端、瘤床(原发肿瘤为T4b时)和高危淋巴结引流区,高危淋巴结引流区范围须根据原发部位不同进行调整(见表、图1),计划靶区(PTV)在CTV基础上形成,一般向左右方向外放5~7 mm,头脚方向外放10 mm。尚无术前放疗靶区范围相关研究,可参照目前国家癌症中心放疗科采取的靶区定义:GTV为前CT或磁共振成像(MRI)及胃镜银夹显示的胃原发肿瘤部位(GTV)和周围转移的区域淋巴结(GTVnd,定义为最大短径≥0.8 cm)。CTV包括GTV和高危淋巴结引流区(见表、图2),PTV在CTV基础上形成,一般向左右方向外放5~7 mm,头脚方向外放10 mm。术前放疗剂量(DT)为40~45 Gy,治疗中评估后决定手术或继续行根治性放疗。根治性放疗总剂量为50~60 Gy。姑息性放疗剂量为30~40 Gy。
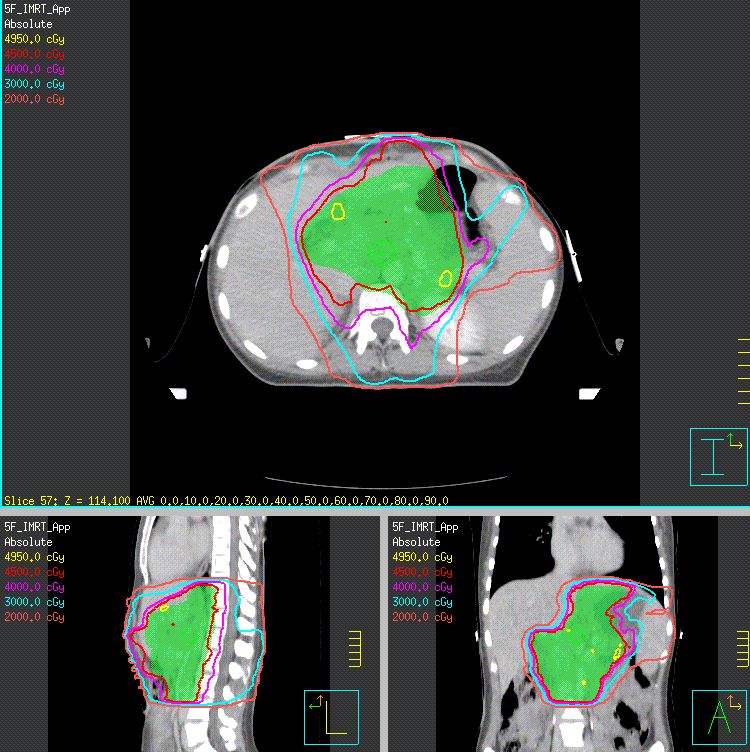
图1.胃癌术后放疗靶区勾画
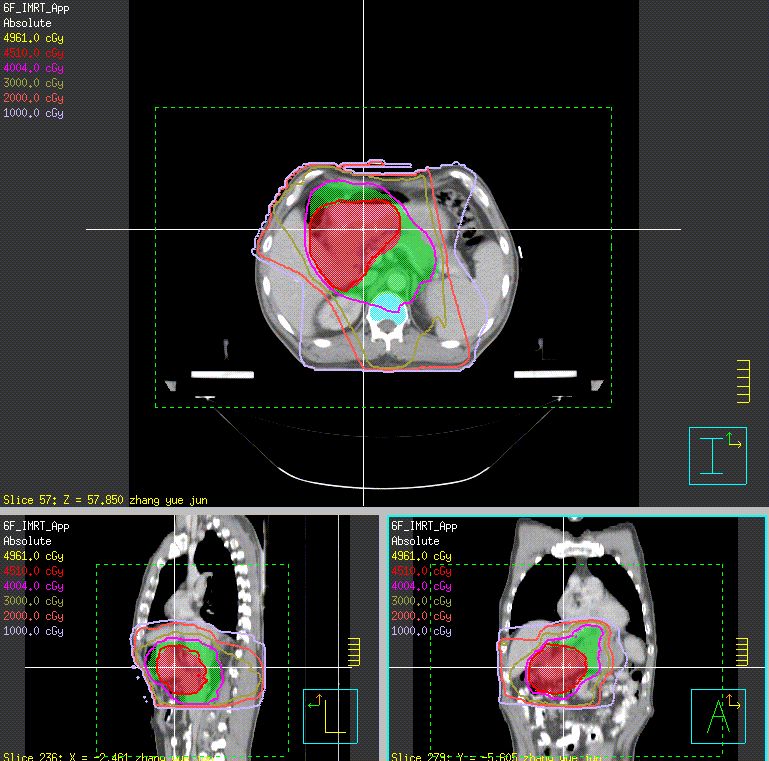
图2.胃癌术前靶区勾画
表1.根据胃癌不同原发部位所照射的淋巴结引流区
结语
胃癌同步放化疗引起不良反应的困境已获解决,但是胃癌D2根治术后同步放化疗疗效的循证依据仍待突破,术后同步放化疗可作为手术未达D2切除的进展期胃癌患者的有效补充,也可能为部分D2切除术患者带来获益。可切除的局部晚期胃癌患者术前放化疗安全性且近期疗效已得到肯定,期待患者生存获益可以得到Ⅲ期临床研究的数据证实。
综上所述,对于可切除的局部晚期胃癌患者,同步放化疗仍为多学科治疗策略的重要组成,特别是新辅助治疗,也可能使部分病变转为可手术切除病变;未行放疗的局部复发患者可考虑行姑息放疗,局部控制的提高是否可以转化为生存获益有待研究。
作者 | 任骅(中国医学科学院肿瘤医院深圳医院)



